我室王斌举教授课题组在金属酶中氧气活化机理研究方面取得进展,相关成果以“Fenton-DerivedOH Radicals Enable the MPnS Enzyme to Convert 2-Hydroxyethylphosphonate toMethylphosphonate: Insights from Ab Initio QM/MM MD Simulations”为题发表于《美国化学会志》 (J. Am. Chem. Soc., 2019, DOI: 10.1021/jacs.9b02659)。
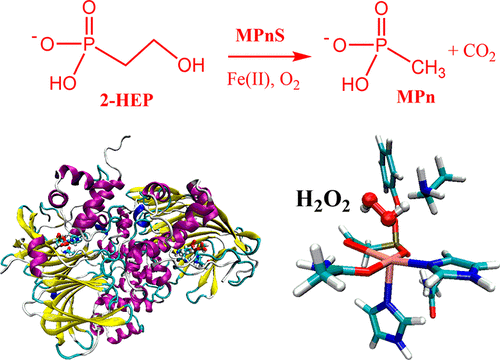
氧气在金属酶中的活化构成金属酶的主要功能之一。很多的金属铁酶以及铜酶通过活化氧气分子生成不同的含氧金属物种来调控各式各样的氧化反应,比如C-H的活化以及官能化,杂原子的氧化,C-C键的断裂/生成反应等。由于氧气中O-O键能很高(119kcal/mol), 大多数金属酶中氧气的活化都需要还原剂/电子供体的参与。还原剂通过向金属-O2的电子供给,能够极大削弱O-O键的键能。然而,非血红素铁酶MPnS以及HEPD可以在无还原剂参与下催化底物C-H键的活化以及C-C断裂反应。虽然之前实验以及理论对HEPD以及MPnS酶进行了大量研究,但是针对O2分子的活化机理以及相应的酶催化机理仍然不清楚,甚至在很多方面存在争议性。
本课题采用QM/MM MD水平上的Metadynamics自由能计算,基于最新解析的MPnS酶的晶体结构,研究了MPnS酶中氧气的活化以及整个催化循环机理。我们发现活性区间的赖氨酸残基(Lys28)对氧气的活化起关键作用。铁-超氧中间体(Fe(III)-O2-)在夺取底物H原子的同时伴随Lys28上的质子向Fe-OOH近端O上的转移,生成H2O2中间体。 二价铁Fe(II)活性中心进一步通过芬顿反应方式活化H2O2,生成亚稳的OH自由基中间体。生成的OH自由基可以自发进攻底物羰基碳,同时伴随Fe(III)-OH上的质子向脱质子的赖氨酸Lys28的转移,最后生成实验上检测到的高价Fe(IV)=O活性物种。因此,我们的多尺度理论模拟揭示赖氨酸可以通过质子-穿梭机理参与氧气的活化,这极大拓展了我们对金属酶中氧气活化机理的认识。
本课题计算模拟主要由王斌举完成,郑州大学宋金帅副教授参与了57Fe穆斯堡参数的计算,数据分析以及文章撰写由王斌举,希伯来大学Sason Shaik 教授,曹泽星教授,巴塞罗那Carme Rovira教授以及宋金帅副教授共同完成。最后特别感谢国重以及福建省理论与计算化学重点实验室计算平台的支持,以及厦门大学校内资金的支持。
论文链接:https://pubs.acs.org/doi/abs/10.1021/jacs.9b02659